جدول تناوبی عنصرهای شیمیایی، نمایش جدولی عنصرهای شیمیایی بر...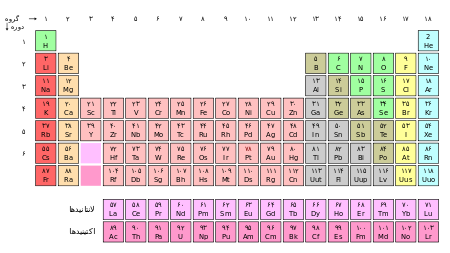
جدول تناوبی
جدول تناوبی عنصرهای شیمیایی، نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد اتمی کمتر به سوی عدد اتمی (شمار پروتونهای) بالاتر است. شکل استاندارد این جدول ۱۸ × ۷ است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار ستون مستطیلی عبارتند از: بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی در وسط و بلوک اف یا همان فلزات واسطهٔ داخلی در پایین. ردیفهای این جدول، دوره و ستونهای آن یا همان ستونهای s و d و p، گروههای جدول تناوبی نام دارند. همچنین گاهی برخی از این گروههای نامهای ویژهای دارند برای نمونه گروه هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی چه به شکل مستطیلی و چه به شکلهای دیگر برای بررسی بهتر ویژگیهای شیمیایی عنصرها بوده است این جدول کاربرد زیادی در دانش شیمی و پردازش رفتار عنصرها دارد.
اعتبار جدول تناوبی به پای دیمیتری مندلیف نوشته شده است با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او این جدول را در سال ۱۸۶۹ منتشر کرد این نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را درست کرد تا ویژگیهای دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و جای آنها را خالی گذاشته بود. کم کم با پیشرفت دانش، عنصرهای تازه تری شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیه سازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گستده تر شده است.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (آناناکتیوم) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از آناناکتیوم اند و البته این پرسش را پیشرو دارند که عنصرهای تازه تر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شده است.
روش دستهبندی
گروه
یک گروه یا خانواده یک ستون عمودی از جدول تناوبی است. عنصرهای یک گروه معمولاً ویژگیهای نزدیک به هم بیشتری دارند تا عنصرهای یک دوره یا بلوک. دانش مکانیک کوانتوم نشان میدهد که دربارهٔ ساختار اتمی پژوهش میکند نشان میدهد که چون عنصرهای موجود در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی برخوردارند[۷] برای همین ویژگیهای شیمیایی همانندی از خود نشان میدهند و هرچه عدد اتمی آنها بالاتر میرود ویژگیهایشان بیشتر نمود پیدا میکند.[۸] با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ همانندیها در یک گروه مهم اند. به همانندی (شباهت) در یک دوره، همانندی افقی و در یک گروه، همانندی عمودی می گوییم.[۹][۱۰][۱۱]
بر اساس یک قرارداد جهانی، گروهها از ۱ تا ۱۸ شمارهگذاری شدهاند که گروه شمارهٔ یک را نخستین گروه از چپ (فلزهای قلیایی) و آخرین گروه را گروه نخست از راست (گازهای نجیب) در نظر گرفتهاند.[۱۲] در گذشته شمارهٔ گروهها را با عددهای رومی نشان میدادند. همچنین در آمریکا برای گروههای بلوک اس و پی یک حرف A و برای عنصرهای بلوک دی یک حرف B در کنار شمارهٔ رومی گروه میگذاشتند. برای نمونه برای نشان دادن گروه چهار مینوشتند: IVB و برای گروه چهاردهم یا عنصرهای گروه کربن مینوشتند.IVA در اروپا هم همین روش بکار میآمد با این تفاوت که حرف A برای گروههای پیش از گروه ۱۰ و حرف B برای عنصرهای گروه ۱۰ و گروههای پس از آن بکار میرفت. در سال ۱۹۸۸ آیوپاک سامانهٔ نامگذاری تازهای را پیشنهاد کرد و روشهای پیشین همگی فراموش شد.[۱۳]
| گروه | نام |
|---|---|
| 1 | فلزهای قلیایی |
| 2 | فلزهای قلیایی خاکی |
| 11 | فلزهای سکه |
| 12 | فلزهای فرار (کم کاربرد) |
| 13 | گروه بور |
| 14 | گروه کربن |
| 15 | گروه نیتروژن |
| 16 | کالکوژنها |
| 17 | هالوژنها |
| 18 | گاز نجیب; |
عنصرهای یک گروه در شعاع اتمی، انرژی یونش و الکتروندوستی به هم مانند اند. از بالا به پایین، شعاع اتمی عنصرها افزایش مییابد در نتیجه الکترونهای لایهٔ آخر در فاصلهٔ دورتری از هسته جای میگیرند چون ترازهای انرژی بیشتری پُر شدهاند. از بالا به پایین، انرژی یونش کاهش مییابد چون الکترونها کمتر به هسته پیوند خوردهاند و آسان تر میتوان آنها را جدا کرد. با تحلیل مشابه، از بالا به پایین الکتروندوستی عنصرها کاهش مییابد چون فاصلهٔ میان الکترونهای لایهٔ آخر و هسته افزایش مییابد.[۱۴] البته در این میان استثناهایی هم وجود دارد. برای نمونه در گروه ۱۱ الکتروندوستی از بالا به پایین افزایش مییابد.[۱۵]
دوره
یک دوره در جدول تناوبی، یک ردیف افقی از این جدول است. با اینکه عنصرها در یک گروه همانندیهای بسیاری دارند اما بخشهایی از دورهها هستند که از اهمیتی بیش از گروهها برخوردارند. مانند بلوک اف، جایی که لانتانیدها و آکتینیدها دو مجموعهٔ افقی از عنصرهای جدول را میسازند.[۱۶]
عنصرها در یک دوره همانندیهایی از دید شعاع اتمی، انرژی یونی شدن، الکتروندوستی و الکترونخواهی (مقدار انرژی آزاد شده هنگامی که یک الکترون به یک مولکول یا اتم خنثی افزوده میشود) از خود نشان میدهند. در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد این پدیده، به این دلیل است که با افزایش عدد اتمی در یک دوره شمار لایههای الکترونی ثابت است اما شمار پروتونها افزایش مییابد برای همین الکترونها بیشتر به سوی هسته کشیده میشوند.[۱۷] کاهش شعاع اتمی باعث افزایش انرژی یونی شدن میشود (از چپ به راست). هرچه پیوندها در یک عنصر محکم تر باشد انرژی بیشتری هم برای جداسازی یک الکترون نیاز است. الکتروندوستی مانند انرژی یونی شدن رفتار میکند و از چپ به راست افزایش مییابد چون کشش هسته بر روی الکترونها افزایش مییابد.[۱۴] همچنین مقدار الکترونخواهی هم در طول یک دوره اندکی تغییر میکند. فلزها (عنصرهای سمت چپ دوره) معمولاً نسبت به نافلزها (سمت راست دوره) الکترونخواهی پایین تری دارند. این قانون برای گازهای نجیب برقرار نیست.[۱۸]
بلوک
چون لایهٔ آخر الکترونی از اهمیت ویژهای برخوردار است، جدول تناوبی به بخشهایی وابسته به این لایههای الکترونی تقسیم شده است. به هر یک از این بخشها یک بلوک می گویند.[۱۹]بلوک اس دربردارندهٔ دو گروه نخست جدول (فلزهای قلیایی و قلیایی خاکی) و دو عنصر هیدروژن و هلیم است. بلوک پی دربردارندهٔ شش گروه آخر جدول، گروههای ۱۳ تا ۱۸ آیوپاک (۳A تا ۸A در نامگذاری آمریکایی) است. همهٔ شبهفلزات در این بلوک جای میگیرند. بلوک دی دربردارندهٔ گروههای ۳ تا ۱۲ آیوپاک (۳B تا ۸B در نامگذاری آمریکایی) و همهٔ فلزات واسطه است. بلوک اف که بیشتر در پایین بدنهٔ اصلی جدول جای میگیرد دربردارندهٔ لانتانیدها و اکتینیدها است.[۲۰]
دیگر قراردادها
در نمایش جدول تناوبی، لانتانیدها و اکتینیدها بیشتر به صورت دو ردیف اضافی در زیر بدنهٔ اصلی جدول گذاشته میشوند،[۲۱] همچنین در این نمایش دو تک خانه از بدنهٔ اصلی جدول به یکی از عنصرهای این دو مجموعه اختصاص داده میشود. برای نمونه یکی از عنصرهای لانتانیوم یا لوتتیم (برای لانتانیدها) و اکتینیم یا لارنسیم (برای اکتینیدها) را بر میگزینند و آنها را به ترتیب در یک تک خانه میان باریم و هافنیم، و رادیم و رادرفوردیم میگذارند. در دیگر جدولها دو مجموعهٔ لانتانیدها و اکتینیدها به صورت دو ردیف (دوره) در میانهٔ بدنهٔ اصلی جدول جای داده میشود.
| جدول تناوبی با بلوک اف که به صورت جداگانه در پایین آمده (راست)، بلوک اف در میانهٔ جدول (چپ) | |
در برخی جدولها یک خط جداکنندهٔ فلزها از نافلزها هم گنجانده میشود.[۲۲] همچنین ممکن است در یک جدول دستههای گوناگونی از عنصرها برجسته تر نمایان شوند، برای نمونه میتوان به فلزهای واسطه، Post-transition metal و شبهفلزها اشاره کرد.[۲۳] همچنین بسته به کاربرد جدول، ممکن است گروههای ویژهای از عنصرها مانند فلزهای دیرگداز و فلزهای کمیاب که خود زیرگروه فلزهای واسطهاند هم ممکن است گاهی پررنگ تر نمایش داده شوند.[۲۴][۲۵]
ویژگیهای تناوبی
آرایش الکترونی

آرایش الکترونی عنصرهای جدول، الگویی تکرار شونده دارند. الکترونها در هر عنصر، مجموعهای از لایههای الکترونی را پُر میکند. هر لایهٔ الکترونی از یک یا چند زیرلایه ساخته شده است که به آنها لایههای s و p و d و f و g گفته میشود. هر چه عدد اتمی افزایش یابد، لایهها و زیرلایههای الکترونی بیشتری پُر میشود. این لایهها بر پایهٔ اصل آفبا یا قانون تراز انرژی پر میشوند (همانند نموداری که کشیده شده است). برای نمونه آرایش الکترونی نئون با عدد اتمی ۱۰ عبارت است از: 1s2 2s2 2p6 که دو الکترون در لایهٔ نخست و هشت الکترون در لایهٔ دوم (دو تا در زیرلایهٔ s و شش تا در زیرلایهٔ p) جای میگیرد. برای نمونه فلزهای قلیایی و عنصر هیدروژن همگی تنها یک الکترون در لایهٔ اس دارند.[۲۶][۲۷]
ویژگیهای یک عنصر بیشتر به آرایش الکترونی اش وابسته است درنتیجه چون آرایش الکترونی عنصرها در جدول از نظم روشنی پیروی میکند، میتوان برخی رفتارهای فیزیکی و شیمیایی عنصرها در جدول را پیش بینی کرد. در جدول کناری به برخی از این رفتارها اشاره شده است. پیش از آنکه نیلز بور نظریه اش پیرامون آرایش الکترونی را مطرح کند، با توجه به این ویژگی پلهکانی عنصرها، جای عنصرها در جدول پیش بینی شده بود.[۲۶][۲۷]
شعاع اتمی
تغییر شعاع اتمی در جدول تناوبی قابل پیشبینی و البته قابل توضیح است. برای نمونه شعاع اتمی عموماً در طول هر دورهٔ جدول از فلزهای قلیایی به سوی گازهای نجیب کاهش مییابد ولی در گروهها از بالا به پایین رو به افزایش است. نرخ تغییر شعاع اتمی میان گازهای نجیب در پایان یک دوره و فلزهای قلیایی در آغاز دوره، شیب تندی است. این تغییر شعاع اتمی و در کنار آن تغییر در ویژگیهای فیزیکی و شیمیایی عنصرها را میتوان با کمک نظریههای اتمی دربارهٔ لایههای الکترونی توضیح داد. این تغییرها شاهدی بر درستی نظریهٔ کوانتوم است.[۲۸]
انرژی یونش
نخستین انرژی یونش، انرژی لازم برای کندن سست ترین الکترون از یک اتم خنثی در حالت گازی است.
پیشینه
نخستین تلاشها

قرمز: شناخته شده در دوران باستان
نارنجی: شناخته شده در هنگامهٔ لاوازیه در ۱۷۸۹
زرد: شناخته شده در هنگامهٔ مندلیف در ۱۸۶۹
سبز: شناخته شده در هنگامهٔ دمینگ در ۱۹۲۳
آبی: شناخته شده در هنگامهٔ سیبورگ در ۱۹۴۵
خاکستری: شناخته شده تا سال ۲۰۰۰
بنفش: شناخته شده تا سال ۲۰۱۲
در سال ۱۷۸۹ آنتوان لاووازیه فهرستی از ۳۳ عنصر شیمیایی را منتشر کرد. او این عنصرها را زیر نامهای گازی، فلزی، نافلزی و خاکی دسته بندی کرده بود.[۲۹] از سدههای گذشته شیمیدانان همواره در پی یک دسته بندی دقیق برای عنصرها بودهاند. در سال ۱۸۲۹ یوهان ولفگنگ دوبرآینر دریافت که بسیاری از عنصرها را میتوان بسته به ویژگیهای شیمیایی شان در دستههای سه تایی بخش بندی کرد. برای نمونه لیتیم، سدیم و پتاسیم را با هم در دستهٔ فلزهای واکنش پذیر نرم گذاشت. همچنین او متوجه شد که وقتی عنصرها را به ترتیب وزن اتمی دسته بندی میکند، وزن عنصر دوم (میانی) تقریباً برابر است با میانگین وزن عنصر پیش و پس از خود (عنصر اول و سوم).[۳۰] این پدیده به نام قانون سه تایی یا سه تایی دوبرآینر شناخته شد.[۳۱] شیمیدان آلمانی لئوپولد گملین با همین روش ادامه داد و تا سال ۱۸۴۳ توانست ده دستهٔ سه تایی، سه دستهٔ چهارتایی و یک دستهٔ پنج تایی را شناسایی کند. در سال ۱۸۵۷ ژان باتیست آندره دوما توانست ارتباطهایی میان دستههای گوناگون فلزها بدست آورد. تا این دوره شیمیدانان گوناگون توانسته بودند ارتباطهای گوناگونی میان دستههای کوچک عنصرها بدست آورند اما هیچ یک جدول کلی ارائه نکرده بود.[۳۰]
در ۱۸۵۸ شیمیدان آلمانی فریدریش آگوست ککوله مشاهده کرد که کربن همواره با چهار اتم پیرامون خود پیوند برقرار میکند. برای نمونه در متان یک کربن با چهار هیدروژن پیرامون خود پیوند خورده است. این مفهوم کم کم با نام والانس یا الکترونهای ظرفیت شناخته شد به معنی تعداد عنصرهای گوناگون که با اتمهای گوناگون با هم پیوند میخورند.[۳۲]
در ۱۸۶۲ یک زمین شناس فرانسوی به نام الکساندر-امیل بگویه دو شانکورتوآ یک نمای اولیه از جدول تناوبی را منتشر کرد. او نام آن را مارپیچ خاکی یا مارپیچ گذاشت. او نخستین کسی بود که متوجه ویژگیهای تناوبی عنصرها شد و آنها را به تریب عدد اتمی از کمتر به بیشتر در یک استوانهٔ مارپیچ مرتب کرد. همچنین او نشان داد که عنصرهایی که ویژگیهای مانند هم دارند در فاصلهای ثابت از هم قرار دارند (شمار عنصرهای میان آنها همیشه ثابت است). جدول او برخی یونها و ترکیبها را هم دربرداشت. مقالهای که او دربارهٔ جدولش منتشر کرد بیشتر مطالب مربوط به زمین شناسی را داشت تا دانش شیمی، برای همین تا پیش از جدول دیمیتری مندلیف توجه کمی را به خود جلب کرد.[۳۳]
در ۱۸۶۴ شیمی دان آلمانی، جولیوس لوتار میر جدولی ساخته شده از ۴۴ عنصر را بر پایهٔ الکترونهای لایهٔ ظرفیت (والانس) ارائه کرد. این جدول نشان میداد که عنصرهایی که ویژگیهای مانند هم دارند معمولاً الکترونهای ظرفیت برابر هم دارند.[۳۴] همزمان شیمیدان انگلیسی، ویلیام آدلینگ هم جدولی ساخته شده از ۵۷ عنصر منتشر کرد. جدول آدلینگ بر پایهٔ وزن اتمی بود که چندین جای خالی و نکتهٔ غیرمعمول در آن دیده میشد. او متوجه مفهوم تناوبی بودن جرم اتمی در میان عنصرها و مسئلهٔ گروه بندی عنصرها در جدول شده بود[۳۵] اما هرگز پیگیر ادامهٔ آن نشد.[۳۶] او در ۱۸۷۰ عنصرها را برپایهٔ الکترونهای لایهٔ ظرفیت (والانس) مرتبط کرد و به عنوان جدول پیشنهادی خود ارائه کرد.[۳۷]
شیمیدان انگلیسی جان نیولندز از سال ۱۸۶۳ تا ۱۸۶۶ مجموعه مقالاتی را منتشر کرد. او در این مقالهها توضیح میداد که هنگامی که عنصرها به ترتیب از عدد اتمی کمتر به بیشتر مرتب شوند در دستههای هشتایی ویژگیهای فیزیکی و شیمیایی همانندی را تکرار میکنند او این تناوب و تکرار هشت تایی را به هشتگانهای موسیقی همانند کرد.[۳۸][۳۹] قانون هشتگانهای نیولندز از سوی همکارانش احمقانه دانسته شد و جامعهٔ شیمی حاضر به انتشار کار او نشد.[۴۰] برخلاف این برخورد، نیولندز دادههای جدول هشتایی خود را جمع آوری کرد و از آن برای پیشبینی عنصرهای ناشناخته مانند ژرمانیم بهره برد.[۴۱] جامعهٔ شیمی پنج سال پس از آنکه جدول تناوبی مندلیف به جهان معرفی شد به کار نیولندز بها داد.[۴۲]
در سال ۱۸۶۷ یک شیمیدان زادهٔ دانمارک به نام گوستاووس هنریکس یک جدول تناوبی مارپیچ پیشنهاد کرد این جدول برپایهٔ طیف اتمی، وزن و همانندیهای شیمیایی بود. جدول او به عنوان کاری، منحصربهفرد، درخور توجه و البته تودرتو و پیچیده دانسته شد. چنین توصیفاتی مانع از شناسایی و پذیرش عمومی جدول او شد.[۴۳][۴۴]
جدول مندلیف
استاد روس شیمی، دیمیتری مندلیف و شیمی دان آلمانی، ژولیوس لوتار میر، هر یک به صورت مستقل جدولی را به ترتیب در سالهای ۱۸۶۹ و ۱۸۷۰ منتشر کردند.[۴۵] جدول مندلیف، نخستین نسخه از کارش بود درحالی که جدولی که میر منتشر کرد، نسخهٔ گشترش یافتهٔ جدول پیشین او بود که در سال ۱۸۶۴ منتشر کرده بود.[۴۶] آنها هر دو عنصرها را در ردیفها و ستونها به ترتیب وزن اتمی فهرست کرده بودند. در هر دو جدول در آغاز یک ستون یا ردیف، ویژگیهای عنصرها مرتب تکرار میشد.[۴۷]
مندلیف در این جدول دو انتخاب مهم کرده بود که باعث شد تا جدولش مورد پذیرش عمومی قرار گیرد: نخست اینکه جای عنصرهایی را که هنوز شناسایی نشده بود را خالی گذاشته بود.[۴۸] مندلیف نخستین شیمی دانی نبود که چنین کرده بوداما نخستین کسی بود که با توجه به ردپایی که از جدول داشت جای عنصرها را پیشبینی کرده بود، عنصرهایی مانند گالیم و ژرمانیم عنصرهایی بودند که بعداً شناسایی شدند.[۴۹] انتخاب دوم مندلیف در جاگذاری و دسته بندی عنصرها بود، او گاهی ویژگی وزن اتمی را نادیده گرفته بود و به جایش عنصرها را با توجه به ویژگیهای شیمیایی جاگذاری کرده بود. عنصرهایی مانند تلوریم و ید از این دست بودند. بعدها با پیشرفت علم معلوم شد که مندلیف بدون اینکه بداند عنصرها را به ترتیب افزایش عدد اتمی و بار هسته مرتب کرده بود.[۵۰]
اهمیت عدد اتمی در جاگذاری عنصرها در جدول تناوبی نادیده گرفته میشد تا اینکه وجود و ویژگیهای پروتون و نوترون در هسته فهمیده شد.
گسترش در آینده
مندلیف در سال ۱۸۷۱ جدولش را به روز کرد و جزئیات بیشتری از عنصرهایی که جایشان را پیشبینی میکرد، ارائه داد. او باور داشت که این عنصرها وجود دارند اما هنوز شناسایی نشدهاند.[۵۱] با گذر زمان و شناسایی عنصرهایی که به صورت طبیعی یافت میشوند، جاهای خالی کم کم پر شد. باور عمومی چنین است که آخرین عنصر شناسایی شدهای که به صورت طبیعی پدید میآید فرانسیم است که در سال ۱۹۳۹ شناسایی شد. مندلیف این عنصر را اکا-سزیم (اکا به معنی همانند) نامیده بود.[۵۲] پس از آن، در سال ۱۹۴۰ عنصر پلوتونیم به صورت آزمایشگاهی تولید شد اما در سال ۱۹۷۱ دانشمندان به این نتیجه رسیدند که این عنصر به صورت طبیعی ساخته میشود.[۵۳]
جدول تناوبی پرکاربرد امروزی[۵۴] که به نام جدول تناوبی استاندارد یا جدول تناوبی متداول نیز شناخته میشود، جدولی است که به شیمیدان آمریکایی هوراس گرووز دمینگ نسبت داده میشود. دمینگ در ۱۹۲۳ دو نسخهٔ کوتاه (نسخهٔ مندلیفی) و معمولی (نسخهٔ ۱۸ ستونی) جدول تناوبی را منتشر کرد.[۵۵][n ۲] بعدها در سال ۱۹۲۸ نسخهٔ ۱۸ ستونی جدول دمینگ به صورت گسترده در دسترس مدرسههای آمریکا قرار گرفت. تا دههٔ ۱۹۳۰ جدول دمینگ در بسیاری از کتابها و دانشنامههای شیمی در دسترس بود. همچنین برای سالها توسط انتشارات علمی سرجنت-ولچ منتشر میشد.[۵۶][۵۷][۵۸]
با پیشرفت دانش مکانیک کوانتوم و افزایش دانش دربارهٔ الکترون و نقش آنها در اتم، روشن کرد جایگیری عنصرها در هر دوره (ردیف) از جدول تناوبی با پر شدن یکی از لایههای الکترونی همسنگ است. اتمهای بزرگتر الکترونها و در نتیجه زیرلایههای بیشتری دارند پس در ادامه طول دورههای جدول بیشتر میشود.[۵۹]
در ۱۹۴۵، دانشمند آمریکایی گلن سیبورگ گفت که الکترونها در اکتینیدها مانند لانتانیدها بلوک اف از لایههای الکترونی را پر میکنند چرا که پیش از آن فرض میشد که الکترونها در بلوک دی جای میگیرند. همکار سیبورگ به او توصیه کرد که چنین مطلبی را منتشر نکند و آیندهٔ کاری خود را به خطر نیندازد با این حال او پیشنهاد خود را ارائه داد که از سوی جامعهٔ علمی درست دانسته شد. سیبورگ به تلاش خود ادامه داد و در سال ۱۹۵۱ توانست جایزهٔ نوبل شیمی را به خاطر کار بر روی اکتینیدها از آن خود کند.[۶۰][۶۱][n ۳]
قالبهای جایگزین
غیر از جدول تناوبی استاندارد، جدولهای تناوبی گوناگونی تا کنون ساخته شده است. با گذشت ۱۰۰ سال از معرفی جدول از سوی مندلیف در سال ۱۸۶۹، نزدیک به ۷۰۰ نسخهٔ گوناگون از جدول تناوبی معرفی و منتشر شد.[۶۲] غیر از قالب معمول که به شکل مستطیلی بود قالبهایی دیگری مانند[n ۴] دایرهای، مکعبی، استوانهای، هرمی، مارپیچ، کروی، مربعی، حلزونی، منشور هشت وجهی، به صورت تو در تو (مانند نماد بی نهایت ∞) و حتی جدا جدا هم ساخته شد. هدف از پیشنهاد چنین قالبهایی بیشتر تاکید بر روی یک ویژگی فیزیکی یا شیمیایی ویژه از عنصرها است که در جدول تناوبی سنتی به خوبی دیده نمیشود.[۶۲]
یکی از قالبهای جایگزین و شناخته شدهٔ جدول،[۶۳] نسخهای است که به تئودور بنفی (۱۹۶۰) نسبت میدهند. در جدول بنفی، عنصرها به صورت یک مارپیچ پیوسته در کنار هم جای گرفتهاند به گونهای که هیدروژن در مرکز مارپیچ و عنصرهای واسطه، لانتانیدها و اکتینیدها به صورت بیرونزدگی در کنار جای گرفتهاند. (مانند شکل)[۶۴]
بیشتر جدولهای تناوبی دو بُعدی اند.[۳] با این حال پیش از آنکه مندلیف جدولش را معرفی کند در سال ۱۸۶۲ جدول سه بعدی هم پیشنهاد شده بود. جدولهای تازه تر مانند دسته بندی کورتین (۱۹۲۵)،[۶۵] نظام Lamina رینگلی (۱۹۴۹)،[۶۶] جدول حلزونی گیگر (۱۹۶۵)[۶۷][n ۵]، درخت تناوبی دوفور (۱۹۹۶)[۶۸] و جدول تناوبی استاو (۱۹۸۹)[۶۹] همگی به صورت چهاربعدی توصیف شدهاند. به این صورت که سه بُعد آن، بعدهای فضایی و یک بُعد، رنگ آن در نظر گرفته شده است.[۷۰]
پرسشها و تناقضهای امروز جدول
عنصرهای با ویژگیهای شیمیایی ناشناخته
با وجود آنکه عنصرهای جدول تا آناناکتیوم شناسایی شدهاند اما تنها تا عنصرهای هاسیم (عنصر ۱۰۸) و کوپرنیسیم (عنصر ۱۱۲) ویژگیهای شیمیایی شناخته شده دارند. در حالی که دیگر عنصرها رفتاری متفاوت از آنچه برایشان از راه برون یابی پیشبینی میشود از خود نشان میدهند. برای نمونه برخی پژوهشها میگوید که با اینکه عنصر فلروویوم در گروه کربن جای دارد[۷۱] اما باید رفتاری همانند گاز بی اثر رادون از خود نشان دهد،[۷۲] البته آزمایشهای تازه تر همانندیهای در رفتار شیمیایی فلروویوم و عنصر سرب پیدا کردهاند که این با جدول تناوبی همخوانی بیشتری دارد.[۷۳]
گسترش بیشتر جدول تناوبی
هنوز روشن نیست که آیا عنصرهای تازه تر که در آینده شناسایی میشوند در ردیف هشتم (دورهٔ هشتم) جای میگیرند یا به کلی نظم جدول را به هم میریزند. گلن سیبورگ بر این باور بود که دورهٔ هشتم جدول به گونهای است که دو عنصر ۱۱۹ و ۱۲۰ از بلوک اس، ۱۸ عنصر از بلوک جی و ۳۰ عنصر از بلوکهای اف، دی و پی را دربر میگیرد.[۷۴] برخی فیزیکدانان امروز مانند پکا پیکو به صورت نظری به این نتیجه رسیدهاند که این عنصرهای تازه تر، از اصل آفبا که توضح دهندهٔ چگونگی پُر شدن لایههای الکترونی است، پیروی نخواهند کرد به این ترتیب با شناسایی عنصرهای تازه تر ظاهر جدول تناوبی دچار دگرگونی خواهد شد.[۷۵]
بالاترین عدد اتمی ممکن
بالاترین عدد اتمی ممکن هنوز روشن نیست. نخستین بار الیوت آدامز در ۱۹۱۱ با توجه به شمار عنصرهای جای گرفته در هر ردیف به این نتیجه رسیده بود که وزن اتمی بالاتر از ۲۵۶± (یعنی عنصرهای ۹۹ و ۱۰۰ امروز) ناممکن است و وجود ندارد.[۷۶] پس از آن گفته شد که جدول تناوبی به زودی پس از جزیرهٔ پایداری به پایان خواهد رسید.[۷۷] بر پایهٔ این پیشبینی باید نزدیک به عنصر ۱۲۶ ام جدول به پایان میرسید. پس از آن جان امزلی[۳] و ریچارد فاینمن[۷۸] هر یک به ترتیب پیشبینی کردند که عنصر ۱۲۸ ام و ۱۳۷ ام آخرین عنصرهای جدول اند و در نهایت آلبرت خزان گفت که عنصر ۱۵۵ ام عنصر آخر است.[۳][n ۶]
- مدل بور
مدل بور داشتن عدد اتمی بالاتر از ۱۳۷ را ناممکن می داند چون در این صورت باید الکترونهای ۱s با سرعتی بیشتر از سرعت نور حرکت کند. بنابراین مدل غیر نسبیتی بور در این کاربرد دقیق نیست.[۷۹]
جای هیدروژن و هلیم
هیدروژن و هلیم گاهی در جایی گذاشته میشوند که مطابق آرایش الکترونی شان نیست. برای نمونه برپایهٔ شمار الکترونها معمولاً هیدروژن بالای لیتیم جای میگیرد اما چون گاهی رفتاری همانند فلوئور[۸۰] یا کربن[۸۰] از خود نشان میدهد بالای این دو عنصر هم گذاشته میشود. در حالتهایی که رفتار هیدروژن مانند هیچ عنصری دانسته نمیشود برایش یک گروه تعریف میکنند و آن را در گروه خودش میگذارند.[۸۱] اما هلیم تقریباً همیشه در بالای نئون جای میگیرد چون رفتار شیمیایی بسیار همانندی دارند با این حال دیده شده که آن را بالای برلیم[۱۹] هم بگذارند چون آرایش الکترونی نزدیک به هم دارند. (هلیم: ۱s۲ برلیم: [He] ۲s۲)
عنصرهای تناوب ۶ و ۷ در گروه سوم جدول
گروه سه جدول از چهار عنصر ساخته شده است که دو عنصر نخست یعنی اسکاندیم و ایتریم مورد پذیرش همه است اما بر سر دو عنصر بعدی اختلاف است، برخی می گویند دو عنصر بعدی، لانتان و اکتینیم اند و برخی دیگر می گویند لوتتیم و لارنسیم باید باشند. برسر ویژگیهای فیزیکی و شیمیایی این عنصرها در نظم جدول بحث است که هنوز همگان را قانع نکرده است.[۸۲]
گروههایی که فلزهای واسطه را دربردارند
|
|
این بخش نوشتار نیازمند گسترش است. |
قالب بهینهٔ جدول
|
|
این بخش نوشتار نیازمند گسترش است. |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| گروه | ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ | ||||||||||||||||||||||||||||||||||||||
| ردیف | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۱ |
۱ H |
۲ He |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲ | ۳ Li |
۴ Be |
۵ B |
۶ C |
۷ N |
۸ O |
۹ F |
۱۰ Ne |
||||||||||||||||||||||||||||||||||||||||||||||||
| ۳ | ۱۱ Na |
۱۲ Mg |
۱۳ Al |
۱۴ Si |
۱۵ P |
۱۶ S |
۱۷ Cl |
۱۸ Ar |
||||||||||||||||||||||||||||||||||||||||||||||||
| ۴ | ۱۹ K |
۲۰ Ca |
۲۱ Sc |
۲۲ Ti |
۲۳ V |
۲۴ Cr |
۲۵ Mn |
۲۶ Fe |
۲۷ Co |
۲۸ Ni |
۲۹ Cu |
۳۰ Zn |
۳۱ Ga |
۳۲ Ge |
۳۳ As |
۳۴ Se |
۳۵ Br |
۳۶ Kr |
||||||||||||||||||||||||||||||||||||||
| ۵ | ۳۷ Rb |
۳۸ Sr |
۳۹ Y |
۴۰ Zr |
۴۱ Nb |
۴۲ Mo |
۴۳ Tc |
۴۴ Ru |
۴۵ Rh |
۴۶ Pd |
۴۷ Ag |
۴۸ Cd |
۴۹ In |
۵۰ Sn |
۵۱ Sb |
۵۲ Te |
۵۳ I |
۵۴ Xe |
||||||||||||||||||||||||||||||||||||||
| ۶ | ۵۵ Cs |
۵۶ Ba |
* |
۷۱ Lu |
۷۲ Hf |
۷۳ Ta |
۷۴ W |
۷۵ Re |
۷۶ Os |
۷۷ Ir |
۷۸ Pt |
۷۹ Au |
۸۰ Hg |
۸۱ Tl |
۸۲ Pb |
۸۳ Bi |
۸۴ Po |
۸۵ At |
۸۶ Rn |
|||||||||||||||||||||||||||||||||||||
| ۷ | ۸۷ Fr |
۸۸ Ra |
** |
۱۰۳ Lr |
۱۰۴ Rf |
۱۰۵ Db |
۱۰۶ Sg |
۱۰۷ Bh |
۱۰۸ Hs |
۱۰۹ Mt |
۱۱۰ Ds |
۱۱۱ Uuu |
۱۱۲ Uub |
۱۱۳ Uut |
۱۱۴ Uuq |
۱۱۵ Uup |
۱۱۶ Uuh |
۱۱۷ Uus |
۱۱۸ Uuo |
|||||||||||||||||||||||||||||||||||||
| * لانتانیدها | ۵۷ La |
۵۸ Ce |
۵۹ Pr |
۶۰ Nd |
۶۱ Pm |
۶۲ Sm |
۶۳ Eu |
۶۴ Gd |
۶۵ Tb |
۶۶ Dy |
۶۷ Ho |
۶۸ Er |
۶۹ Tm |
۷۰ Yb |
||||||||||||||||||||||||||||||||||||||||||
| ** آکتینیدها | ۸۹ Ac |
۹۰ Th |
۹۱ Pa |
۹۲ U |
۹۳ Np |
۹۴ Pu |
۹۵ Am |
۹۶ Cm |
۹۷ Bk |
۹۸ Cf |
۹۹ Es |
۱۰۰ Fm |
۱۰۱ Md |
۱۰۲ No |
||||||||||||||||||||||||||||||||||||||||||
|
این یک جدول تناوبی 18 ستونی است که به عنوان جدول تناوبی استاندارد یا معمول، دانسته میشود. این جدول در مقایسه با جدول تناوبی کوتاه یا قالب مندلیف که در آنها گروههای 3 تا 12 حذف شده است، با نام جدول تناوبی بلند هم خوانده میشود. در جدول تناوبی پهن دو ردیف لانتانیدها و آکتینیدها به حای آنکه جداگانه در پایین جدول بیایند، در درون جدول جای گرفتهاند. جدول تناوبی گسترش یافته علاوه بر دو دورهٔ ۸ و ۹، سوپراکتینیدها را هم در خود جای داده است. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||












