یک اتم ، کوچکترین جزء اصلی غیر قابل تقلیل یک سیستم شیمیایی میباشد...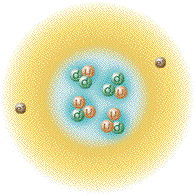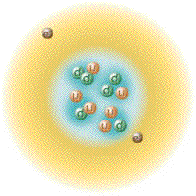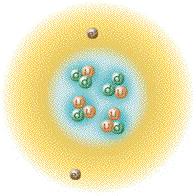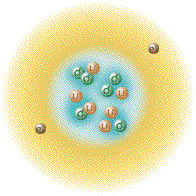

|
ریشه لغوی
این کلمه ، از کلمه یونانی atomos ، غیر قابل تقسیم ، که از a- ، بمعنی غیر و tomos، بمعنی برش ، ساخته شده است. معمولا به معنای اتمهای شیمیایی یعنی اساسیترین اجزاء مولکولها و مواد ساده میباشد.تاریخچه شناسایی اتم
مواد متنوعی که روزانه در آزمایش و تجربه با آن روبه رو هستیم، متشکل از اتمهای گسسته است. وجود چنین ذراتی برای اولین بار توسط فیلسوفان یونانی مانند دموکریتوس (Democritus) ، لئوسیپوس (Leucippus) و اپیکورینز (Epicureanism) ولی بدون ارائه یک راه حل واقعی برای اثبات آن ، پیشنهاد شد. سپس این مفهوم مسکوت ماند تا زمانیکه در قرن 18 راجر بسکوویچ (Rudjer Boscovich) آنرا احیاء نمود و بعد از آن توسط جان دالتون (John Dalton) در شیمی بکار برده شد.راجر بوسویچ نظریه خود را بر مبنای مکانیک نیوتنی قرارداد و آنرا در سال 1758 تحت عنوان:
چاپ نمود.

|
براساس نظریه بوسویچ ، اتمها نقاط بیاسکلتی هستند که بسته به فاصله آنها از یکدیگر ، نیروهای جذب کننده و دفع کننده بر یکدیگر وارد میکنند. جان دالتون از نظریه اتمی برای توضیح چگونگی ترکیب گازها در نسبتهای ساده ، استفاده نمود. در اثر تلاش آمندو آواگادرو (Amendo Avogadro) در قرن 19، دانشمندان توانستند تفاوت میان اتمها و مولکولها را درک نمایند. در عصر مدرن ، اتمها ، بصورت تجربی مشاهده شدند.
اندازه اتم
اتمها ، از طرق ساده ، قابل تفکیک نیستند، اما باور امروزه بر این است که اتم از ذرات کوچکتری تشکیل شده است. قطر یک اتم ، معمولا میان 10pm تا 100pm متفاوت است.ذرات درونی اتم
در آزمایشها مشخص گردید که اتمها نیز خود از ذرات کوچکتری ساخته شدهاند. در مرکز یک هسته کوچک مرکزی مثبت متشکل از ذرات هستهای ( پروتونها و نوترونها ) و بقیه اتم فقط از پوستههای متموج الکترون تشکیل شده است. معمولا اتمهای با تعداد مساوی الکترون و پروتون ، از نظر الکتریکی خنثی هستند.طبقهبندی اتمها
اتمها عموما برحسب عدد اتمی که متناسب با تعداد پروتونهای آن اتم میباشد، طبقهبندی میشوند. برای مثال ، اتم های کربن اتمهایی هستند که دارای شش پروتون میباشند. تمام اتمهای با عدد اتمی مشابه ، دارای خصوصیات فیزیکی متنوع یکسان بوده و واکنش شیمیایی یکسان از خود نشان میدهند. انواع گوناگون اتمها در جدول تناوبی لیست شدهاند.اتمهای دارای عدد اتمی یکسان اما با جرم اتمی متفاوت (بعلت تعداد متفاوت نوترونهای آنها) ، ایزوتوپ نامیده میشوند.
سادهترین اتم
سادهترین اتم ، اتم هیدروژن است که عدد اتمی یک دارد و دارای یک پروتون و یک الکترون میباشد. این اتم در بررسی موضوعات علمی ، خصوصا در اوایل شکلگیری نظریه کوانتوم ، بسیار مورد علاقه بوده است.واکنش شیمیایی اتمها
واکنش شیمیایی اتمها بطور عمدهای وابسته به اثرات متقابل میان الکترونهای آن میباشد. خصوصا الکترونهایی که در خارجیترین لایه اتمی قرار دارند، به نام الکترونهای ظرفیتی ، بیشترین اثر را در واکنشهای شیمیایی نشان میدهند. الکترونهای مرکزی (یعنی آنهایی که در لایه خارجی نیستند) نیز موثر میباشند، ولی بعلت وجود بار مثبت هسته اتمی ، نقش ثانوی دارند.
|
پیوند میان اتمها
اتمها تمایل زیادی به تکمیل لایه الکترونی خارجی خود و (یا تخلیه کامل آن) دارند. لایه خارجی هیدروژن و هلیم جای دو الکترون و در همه اتمهای دیگر طرفیت هشت الکترون را دارند. این عمل با استفاده مشترک از الکترونهای اتمهای مجاور و یا با جدا کردن کامل الکترونها از اتمهای دیگر فراهم میشود. هنگامیکه الکترونها در مشارکت اتمها قرار می گیرند، یک پیوند کووالانسی میان دو اتم تشکیل میگردد. پیوندهای کووالانسی قویترین نوع پیوندهای اتمی میباشند.یون
هنگامیکه بوسیله اتم ، یک یا چند الکترون از یک اتم دیگر جدا میگردد، یونها ایجاد میشوند. یونها اتمهایی هستند که بعلت عدم تساوی تعداد پروتو نها و الکترونها ، دارای بار الکتریکی ویژه میشوند. یونهایی که الکترونها را برمیدارند، آنیون (anion) نامیده شده و بار منفی دارند. اتمی که الکترونها را از دست میدهد کاتیون (cation) نامیده شده و بار مثبت دارد.پیوند یونی
کاتیونها و آنیونها بعلت نیروی کولمبیک (coulombic) میان بارهای مثبت و منفی ، یکدیگر را جذب مینمایند. این جذب پیوند یونی نامیده میشود و از پیوند کووالانسی ضعیفتر است.مرز مابین انواع پیوندها
همانطور که بیان گردید، پیوند کوالانسی در حالتی ایجاد میشود که در آن الکترونها بطور یکسان میان اتمها به اشتراک گذارده میشوند، درحالیکه پیوند یونی در حالی ایجاد میگردد که الکترونها کاملا در انحصار آنیون قرار میگیرند. بجز در موارد محدودی از حالتهای خیلی نادر ، هیچکدام از این توصیفها کاملا دقیق نیست. در بیشتر موارد پیوندهای کووالانسی ، الکترونها بطور نامساوی به اشتراک گذارده میشوند، بطوریکه زمان بیشتری را صرف گردش بدور اتمهای با بار الکتریکی منفیتر میکنند که منجر به ایجاد پیوند کووالانسی با بعضی از خواص یونی میگردد.بطور مشابهی ، در پیوندهای یونی ، الکترونها اغلب در مقاطع کوچکی از زمان بدور اتم با بار الکتریکی مثبتتر میچرخند که باعث ایجاد بعضی از خواص کووالانسی در پیوند یونی میگردد.
اتم
| اتم هلیوم | ||||||||
|---|---|---|---|---|---|---|---|---|
| نمایشی از اتم هلیوم. هسته با رنگ صورتی و ابر توزیع الکترون ها با رنگ سیاه نشان داده شدهاست. هسته اتم هلیوم-۴ (نشان داده شده در راست-بالا) در حقیقت کروی شکل است و شباهت زیادی به ابر الکترونی آن دارد. هرچند در مورد اتمهای پیچیده تر چنین نیست. طول مستطیل سیاه، یک آنگستروم است. | ||||||||
| رده | ||||||||
|
||||||||
| مشخصات | ||||||||
|
اَتُم (به انگلیسی: Atom) واژه ای است یونانی به معنی «ناگسستنی» (من تقسیم نمیشوم)[۲]، اتم واحد تشکیل دهنده تمام مواد (یا تک تک عناصر شیمیایی) است که متشکل از یک هسته مرکزی است که محاطه شده با ابر الکترونی با بار منفی. تعریف دیگری آن را به عنوان کوچکترین واحدی در نظر میگیرد که ماده را میتوان به آن تقسیم کرد بدون اینکه اجزاء بارداری از آن خارج شود.[۳] اتم ابری الکترونی، تشکیلشده از الکترونها با بار الکتریکی منفی، که هستهٔ اتم را احاطه کردهاست. هسته نیز خود از پروتون که دارای بار مثبت است و نوترون که از لحاظ الکتریکی خنثی است تشکیل شدهاست. زمانی که تعداد پروتونها و الکترونهای اتم با هم برابر هستند اتم از نظر الکتریکی در حالت خنثی یا متعادل قرار دارد در غیر این صورت آن را یون مینامند که میتواند دارای بار الکتریکی مثبت یا منفی باشد. اتمها با توجه به تعداد پروتونها و نوترونهای آنها طبقهبندی میشوند. تعداد پروتونهای اتم مشخص کننده نوع عنصر شیمیایی و تعداد نوترونها مشخصکننده ایزوتوپ عنصر است.[۴]
نظریه مکانیک کوانتومی تصویر پیچیدهای از اتم ارائه میدهد و این پیچیدگی دانشمندان را مجبور میکند که جهت توصیف خواص اتم بجای یک تصویر متوسل به تصاویر شهودی متفاوتی از اتم شوند. بعضی وقتها مناسب است که به الکترون به عنوان یک ذره متحرک به دور هسته نگاه کرد و گاهی مناسب است به آنها عنوان ذراتی که در امواجی با موقعیت ثابت در اطراف هسته (مدار: orbits) توزیع شدهاند نگاه کرد. ساختار مدارها تا حد بسیار زیادی روی رفتار اتم تأثیر گذارده و خواص شیمیایی یک ماده توسط نحوه دسته بندی این مدارها معین میشود.[۳]
اجزا
جهت بررسی اجزاء یک ماده، میتوان به صورت پی در پی آن را تقسیم کرد. اکثر مواد موجود در طبیعت ترکیب شلوغی از مولکولهای مختلف است. با تلاش نسبتاً کمی میتوان این مولکولها را از هم جدا کرد. مولکولها خودشان متشکل از اتمها هستند که توسط پیوندهای شیمیایی به هم پیوند خوردهاند. با مصرف انرژی بیشتری میتوان اتمها را از مولکولها جدا کرد. اتمها خود از اجزاء ریزتری بنام هسته و الکترون تشکیل شده که توسط نیروهای الکتریکی به هم پیوند خوردهاند و شکستن آنها انرژی بسی بیشتری طلب میکند. اگر سعی در شکستن این اجرا زیر اتمی با صرف انرژی زیاد بکنیم، کار ما باعث تولید شدن ذرات جدیدی میشویم که خیلی از آنها بار الکتریکی دارند. [۳]
همانطور که اشاره شد اتم از هسته و الکترون تشکیل شدهاست. جرم اصلی اتم در هسته قرار دارد؛ فضای اطراف هسته عموماً فضای خالی میباشد. هسته خود از پروتن (که بار مثبت دارد)، و نوترن (که بار خنثی دارد) تشکیل شده. الکترون هم بار منفی دارد. این سه ذره عمری طولانی داشته و در تمامی اتمهای معمولی که به صورت طبیعی تشکیل میشوند یافت میشود. بجز این سه ذره، ذرات دیگری نیز در ارتباط با آنها ممکن است موجود باشد؛ میتوان این ذرات دیگر را با صرف انرژی زیاد نیز تولید کرد ولی عموماً این ذرات زندگی کوتاهی داشته و از بین میروند.[۳]
اتمها مستقل از اینکه چند الکترون داشته باشند (۳ تا یا ۹۰ تا)، همه تقریباً یک اندازه دارند. به صورت تقریبی اگر ۵۰ میلیون اتم را کنار هم روی یک خط بگذاریم، اندازه آن یک سانتیمتر میشود. به دلیل اندازه کوچک اتمها، آنها را با واحدی به نام آنگستروم که برابر ۱۰- ۱۰ متر است میسنجند.[۳]
ذرات زیراتمی
با وجود اینکه منظور از اتم ذرهای تجزیه ناپذیر بود، امروز میدانیم که اتم از ذرات کوچکتری تشکیل شدهاست. الکترونها، پروتونها و نوترونها ذرات تشکیل دهندهٔ اتم هستند. الیته یون هیدروژن بدون الکترون و نیز هیدروژن-۱ بدون نوترون است.
در مدل استاندارد، الکترونها ذرات بنیادی، یعنی بدون ساختار داخلی، پنداشته میشوند؛ در حالی که پروتونها و نوترون از ذرات دیگری به نام کوارک تشکیل شدهاند.
هسته
هسته دارای نوترون و پروتون است. پروتون دارای بار مثبت (+) و نوترون بدون بار است.
ابر الکترونی
این مدل پیشنهاد شده تنها از یک شخص منتشر نشده و ایده چندین دانشمند و محقق در سال 1935 میباشد در این مدل مانند مدل بور (منظومه شمسی) هسته عمده جرم اتم را تشکیل میدهد و در مرکز ، الکترون با انرژی مختلف به دور هسته در گردش میباشد و الکترونها در لایه ای با انرژی معینی وجود دارند .
مدلهای اتمی
مدل اتمی دموکریت
دموکریت در ۵۰۰سال قبل از میلاد اوّلین تحقیقها را در رابطه با اتم انجام داد. البته نتایج آزمایشها او امروزه هیچ کدام مورد قبول نیست اما اصلی ترین گام در راستای تحقیق در رابطه با اتم بود. نام اتم به معنای تجزیه ناپذیر را نیز او انتخاب کرد. نظریه های او بسیار ابتدایی بود اما باید توجه داشت که تا زمانی که نمیتوان اتم را به چشم دید صحبت در رابطه با آن نیز تنها حدس است. او بر این عقیده بود که:
- ماده ساختار ذرّهای دارد یعنی از ذرّهها بسیار کوچکی ساخته شدهاست که خود آن را میتوان تجزیه ناپذبر نامید.
- اتم مواد مختلف در شکل بایکدیگر متفاوت است. برای مثال مواد تیز و برنده یا ترش دارای اتمی با لبههای تیز به شکلهایی چون مثلث هستند یا مواد نرم و شیرین دارای شکلی دایرهای.(البته این مورد در نظرات بعدی کاملا رد شد.)
مدل اتمی دالتون
نظریهٔ اتمی دالتون: دالتون نظریه اتمی خود را با اجرای آزمایش در هفت بند بیان کرد.
- ماده از ذرههای تجزیه ناپذیری به نام اتم ساخته شدهاست.
- همهٔ اتمهای یک عنصر، مشابه یکدیگرند.
- اتمها نه به وجود میآیند و نه از بین میروند.
- همهٔ اتمهای یک عنصر جرم یکسان و خواص شیمیایی یکسان دارند.
- اتمهای عنصرهای مختلف به هم متصل میشوند و مولکولها را به وجود میآورند.
- در هر مولکول از یک ماده مرکب معین، همواره نوع و تعداد نسبی اتمهای سازنده ی آن یکسان است.
- واکنشهای شیمیایی شامل جابه جایی اتمها و یا تغییر در شیوهٔ اتصال آنها است.
نظریههای دالتون نارساییها و ایرادهایی دارد و اما آغازی مهم بود. مواردی که نظریهٔ دالتون نمیتوانست توجیه کند:
- پدیدهٔ برقکافت (الکترولیز) و نتایج مربوط به آن
- پیوند یونی - فرق یون با اتم خنثی
- پرتو کاتدی
- پرتوزایی و واکنشهای هستهای
- مفهوم ظرفیت در عناصر گوناگون
- پدیدهٔ ایزوتوپی
قسمت اول نظریهٔ دالتون تأیید فیلسوف یونانی (دموکریت) بود.
نظریهٔ دالتون از سه قسمت اصلی (قانون بقای جرم - قانون نسبتها معین - قانون نسبتهای چندگانه) میباشد.
مطالعهٔ اتمها و ذرات ریزتر فقط به صورت غیرمستقیم و از روی رفتار (خواص) امکان پذیر است.
اولین ذرهٔ زیراتمی شناخته شده الکترون است. مواردی که به کشف و شناخت الکترون منجر شد:
- الکتریسیتهٔ ساکن یا مالشی
- پدیدهٔ الکترولیز (برقکافت)
- پرتو کاتدی
- ۴پدیدهٔ پرتوزایی
مدل اتمی جوزف تامسون انگلیسی
مدل اتمی تامسون (کیک کشمشی، مدل هندوانه ای یا ژله میوه دار)
- الکترون با بار منفی، درون فضای ابرگونه با بار مثبت، پراکنده شدهاند.
- اتم در مجموع خنثی است. مقدار بار مثبت با بار منفی برابر است.
- این ابر کروی مثبت، جرمی ندارد و جرم اتم به تعداد الکترون آن بستگی دارد.
- جرم زیاد اتم از وجود تعداد بسیار زیادی الکترون در آن ناشی میشود.
مدل اتمی ارنست رادرفورد نیوزلندی
۱)هر اتم دارای یک هسته کوچک است که بیشتر جرم اتم در آن واقع است.
۲)هسته اتم دارای بار الکتریکی مثبت است.
۳)حجم هسته در مقایسه با حجم اتم بسیار کوچک است زیرا بیشتر حجم اتم را فضای خالی تشکیل میدهد.
۴)هسته اتم بوسیله الکترونها محاصره شدهاست.
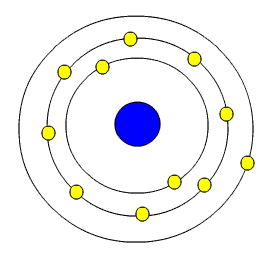
مدل اتمی نیلز بور
او یکی از محققان موفق در این راه بود که با وجود اشتباه بودن مدل او بازهم در خیلی مکانها مانند انرژی اتمی از آن استفاده میشود.
- اتم دارای هسته کوچک اما سنگین با بار مثبت است
- هسته در اتم در حجم کمی قرار دارد که اطراف آن الکترونها بر روی مدارهایی مانند منظومه شمسی به دور آن میچرخند.
اطلاعات جدیدی اضافه شد:
همچنین ایشان بر این باور بودند که الکترونها بر روی مدارهایی به دور هستهٔ اتم پیوسته در حال گردش اند و این نظریه علاوه بر نارسا بودن اطلاعات
سودمندی در رابطه با ساختار اتم میدهد , منطور از نارسا بودن این است که شکلهای الکترونها به صورت ناقص ترسیم شده میباشد در حالی که امروزه میدانیم
نظریه کامل تری با نام مد لایهای عرضه شدهاست.
مدل اتمی جیمز چادویک
قطعا مدل اتمی بور با نقص قابل توجهی رو به رو بود،آن هم نبود نوترون یا ماده ای که دافعه ای که بین پروتون ها در مرکز هسته را از بین ببرد وجود نداشت و بنابر این چادویک بر درستی مدل منظومه شمسی نیلز بور تاکیید کرد اما نقص آن را با توضیح وجود نوترون در هسته ی اتم کامل کرد و از آن به بعد اصلاحات دیگری بر روی هسته ی اتم انجام نشده است ولی البته دانشمندان بزرگی همچون اروین شرودینگر هم بعد از او نیز نظریات اتمی زیادی دادن ولی هنوز هم کاملترین نظریه متعلق به جیمز چادویک (در رابطه با هسته اتم)است.
....=== مدل اتمی لایهای === یک مدل اتمی است که امروزه پذیرفته شدهاست ولی هنوز از مدل اتمی بور برای نمایش اتم استفاده میشود در این مدل مانند مدل بور هسته که عمدهٔ جرم اتم را تشکیل داده در مرکز اتم قرار دارد و الکترونها با انرژیهای مختلف به دور هسته در حال گردش هستند با این تفاوت که در این مدل الکترونها به شکل ابری که ابر الکترونی نامیده شدهاست در اطراف هسته اتم ودر فضای بسیار بزرگی که قطر آن ۱۰۰۰۰ برابر قطر هستهٔ اتم است در حرکتند





